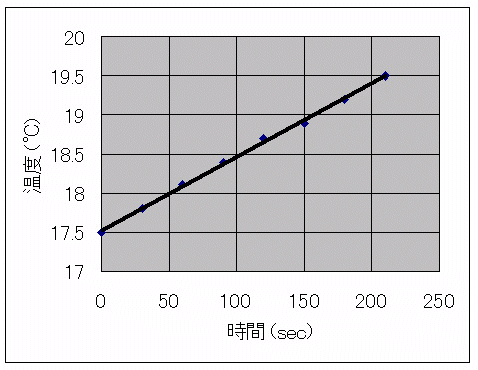
熱量計の100mlの蒸留水を入れ、電流約1.5A、電圧約4Vにあわせて、水当量を測定したところ、温度と時間の変化は表1のようでした。
表1 温度と時間の変化
|
S (sec) |
T (℃) |
E (V) |
I (A) |
|
0 |
17.5 |
3.8 |
1.5 |
|
30 |
17.8 |
3.9 |
1.5 |
|
60 |
18.1 |
3.9 |
1.5 |
|
90 |
18.4 |
3.9 |
1.5 |
|
120 |
18.7 |
3.9 |
1.5 |
|
150 |
18.9 |
3.9 |
1.5 |
|
180 |
19.2 |
3.9 |
1.5 |
|
210 |
19.5 |
3.9 |
1.5 |
図2 温度と時間の変化
図3 使用した電圧と電流の変化
この結果から水当量を求める。
ΔT=T2−Tl=2.00 ℃
S=t2−tl=210 sec
E=3.88 V
I=1.50 A
W=E・I・S/△T [J/deg]
= 610.31 = 610[J/deg]
1cal=4.184 J より、
610[J/deg]=146 [cal/deg]
熱量計に水をX ml入れ、次に、DMFを(100−X)ml入れます。かき混ぜ棒で攪拌しながら30秒毎に温度を読み、測定した結果、次のような表2になった。
DMFの量を10,25,50,75,90 vol%と変えました。
表2 各割合で混合した時の温度変化(℃)
|
S (sec) |
DMF 10% |
DMF 25% |
DMF 50% |
DMF 75% |
DMF 90% |
|
0 |
16.1 |
16.1 |
16.2 |
17.85 |
17.7 |
|
30 |
20.1 |
26.05 |
24.1 |
34.2 |
25.9 |
|
60 |
20.0 |
25.7 |
33.6 |
33.7 |
25.6 |
|
90 |
19.95 |
25.6 |
33.28 |
33.43 |
25.4 |
|
120 |
19.9 |
25.43 |
32.96 |
33.0 |
25.2 |
|
150 |
19.85 |
25.3 |
32.58 |
32.0 |
25.04 |
|
180 |
19.8 |
25.2 |
32.4 |
32.4 |
24.9 |
|
210 |
19.76 |
25.08 |
32.15 |
32.13 |
24.8 |
|
240 |
19.75 |
24.95 |
31.95 |
31.88 |
24.65 |
|
270 |
19.7 |
24.85 |
31.72 |
31.7 |
24.53 |
|
300 |
19.7 |
24.75 |
31.5 |
31.46 |
24.4 |
|
330 |
19.68 |
24.64 |
31.35 |
31.25 |
24.35 |
|
360 |
19.63 |
24.56 |
31.2 |
31.1 |
24.25 |
図4 各割合(vol%)で混合した時の温度変化(℃)
各割合で混合した時の温度変化からΔTを求め、式(1)から希釈熱を算出したのが表3です。
希釈度とは、溶質1molを溶かしている溶液のリットル数で表されます。
表3 希釈熱の算出
|
DMF (vol%) |
ΔT (℃) |
ΔH (cal/mol) |
希釈度 (-) |
希釈熱 Q(cal) |
|
10 |
4.00 |
580 |
0.84 |
4880 |
|
25 |
9.95 |
1450 |
0.33 |
4860 |
|
50 |
17.90 |
2610 |
0.17 |
4370 |
|
75 |
16.35 |
2390 |
0.11 |
2660 |
|
90 |
8.20 |
1200 |
0.09 |
1110 |
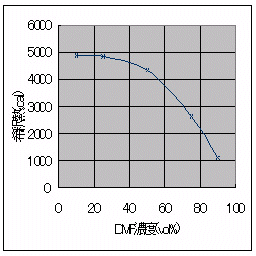
図5 DMF濃度と希釈熱の関係
図6 DMFの希釈度と希釈熱の関係
この結果から、DMFの水への無限大希釈熱は4.89 (kcal)でした。