■第ニ章 実験方法
一般の蒸留水には空気中の炭酸ガスが含有しているため、比較的大きな電導度をもっている。この実験で用いる蒸留水は必ず脱炭酸ガス処理しなければならない。そこで、図のようなカラムA部分にソーダ石灰を入れた装置で脱炭酸水Bを作成する。
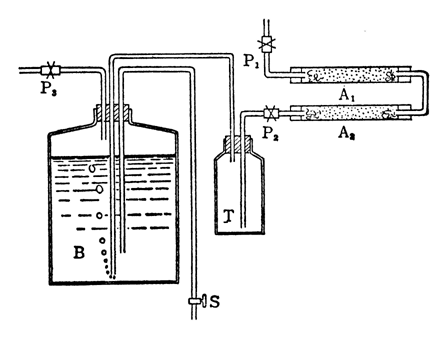
図1 脱炭酸水の作成装置
(文献より引用)
電導度の測定には、図2のような測定容器を用いる。電極は白金黒白金電極で、銅線との導通をはかるため、水銀が入れられているので、洗浄のために容器を逆さにするときは、銅線を抜き、穴に指を当てて水銀が流れ落ちないように注意する。
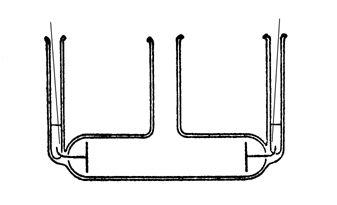
図2 測定容器
(文献より引用)
測定容器は、容器定数Kcを予め測定する。
容器にKCl標準溶液を入れ、容器の抵抗RKを測定することによって、容器定数Kcを求める。
Kc = RKc・κc
KCl標準溶液は、KCl 7.479gを1000mlに脱炭酸水で溶かしたもの(1)と、さらに、それを10倍希釈したもの(2)を作成する。文献によるそれらのKCl標準溶液の比電導度κc(25℃)は表1のとおりである。
表1 KCl標準溶液の比電導度κc(25℃)
|
|
|
|
|
|
|
|
|
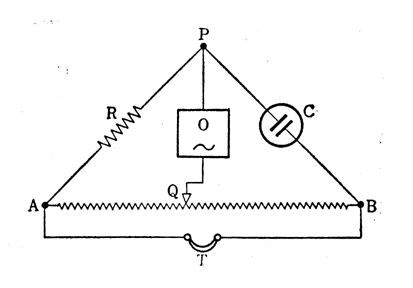
図3 コウラッシュ・ブリッジ(Kohlrausch bridge)
(文献より引用)
酢酸水溶液を1/16, 1/32, 1/64Nの各溶液を準備する。まず、1/16Nの酢酸を作り、NaOH標準液で滴定し、あとは、2倍希釈で用意する。
容器定数を測定した容器を用いて、1/16N溶液の抵抗Rを図3の電導度測定装置で求める。
R = Kc/κ
Λ = 1000/C・κ
これより、1/16N酢酸溶液の当量電導度Λが求められる。同様に、1/32、1/64N酢酸溶液についてもΛを求める。