■第一章 目的と理論
[目的]
Hittorf法を用いてH+、Cl−の輸率を測定する。
[理論]
イオン伝導度lAという陰イオンAと、lKという陽イオンKとからできている電解質が一定時間の間に運ぶ全電気量の中で、陰イオン及び陽イオンが運ぶ電気量の割合t−及びt+は、
t−=lA/(lA+lK)
t−=lK/(lA+lK)
t−+t+=(lA+lK)/(lA+lK)=1
このt−及びt+を陰イオン及び陽イオンの輸率という。
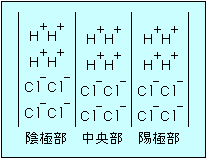
Fig.1 電解前のイオン分布
Fig.1は塩酸の電解前における陰、陽両イオンの分布の有様を表わしたものでH+は水素イオン、Cl−は塩素イオンを表わしたものとする。
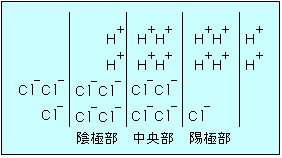
Fig.2 電解後のイオン分布
そこでこの溶液に一定時間直流の電気を通じたところ仮にH+が2mol動いて2ファラデーの電気を運んだ間にCl−は陽極に向かって3mol動いて3ファラデーの電気を運んだとする(Fig.2に示す)。すると全体としては(2+3)ファラデーの電気が運ばれていることからH+の輸率は、2/(2+3)、Cl−の輸率は3/(2+3)となるわけである。この際の陽極部におけるHClの減少量を見ると2molが減少している。よって、
H+の輸率=(陽極における塩酸の減少量)/(全電解量)
で求めることができ、H+とCl−の輸率の和は1なので、
Cl−の輸率=(1−H+の輸率)
で求めることができる。この実験では陰極部をNa2CO3で滴定してHClの増加量を見ることによりH+の輸率を測定する。
H+の輸率=(陰極におけるHClの増加量)/(全電解量)によって求める。全電解量はクーロメーターによって求める。
・クーロメーター
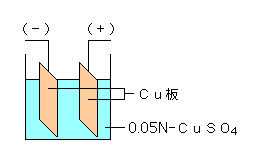
Fig.3 クーロメーター
Fig.3の(−)側のCu板に析出したCuの量をはかることにより全電解量を求めることができる。
Cuの析出量をCu1当量(63.5/2=31.8)で割ることで、全電解量[F]を求めることができる。