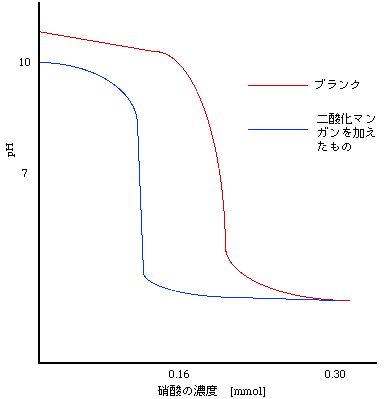
Fig-4滴定曲線
ブランク実験
硝酸ナトリウム溶液(0.1mol/l)中の水酸化ナトリウム(0.1mol/l)を硝酸標準溶液(0.02mol/l)で滴定する。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
当量点=10.5ml
二酸化マンガンを加えての実験
硝酸標準溶液(0.1mol/l)中の水酸化ナトリウム(0.1mol/l)を硝酸(0.02mol/l)で滴定する。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
縦軸にpH、横軸に硝酸の量(mmol)をとりグラフを書く。そのグラフをFig-4に示す。

Fig-4滴定曲線
Fig-4の両滴定曲線は、一点で交差することになる。
赤(ブランク)の滴定曲線を基準にとり、同一pHで青(二酸化マンガンを加えたもの)の滴定曲線の硝酸の量(mmol)から赤の滴定曲線の硝酸の量(mmol)を差し引きΔx(mol)とすると
ここで[≡M+]および[≡MO-]は二酸化マンガン1g当りの荷電サイト量(mol)を表わし、mは二酸化マンガン試料の質量(g)である。σは正味の比電荷(符号を含み[mmol-1]の単位をもつ。)とよぶことができる。Δxの値からσを計算しpHに対してプロットする。て滴定曲線の交点ではσ=0であり、このときのpHがゼロ電荷点(PZC)である。
m=3.335g
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pHとσとの関係をFig-5に示す。
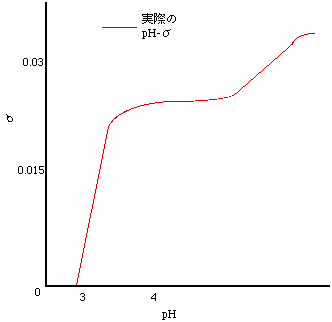
Fig-5pHとσの関係
上のグラフよりσ=0の点のpH ゼロ電荷点(PZC)=2.90